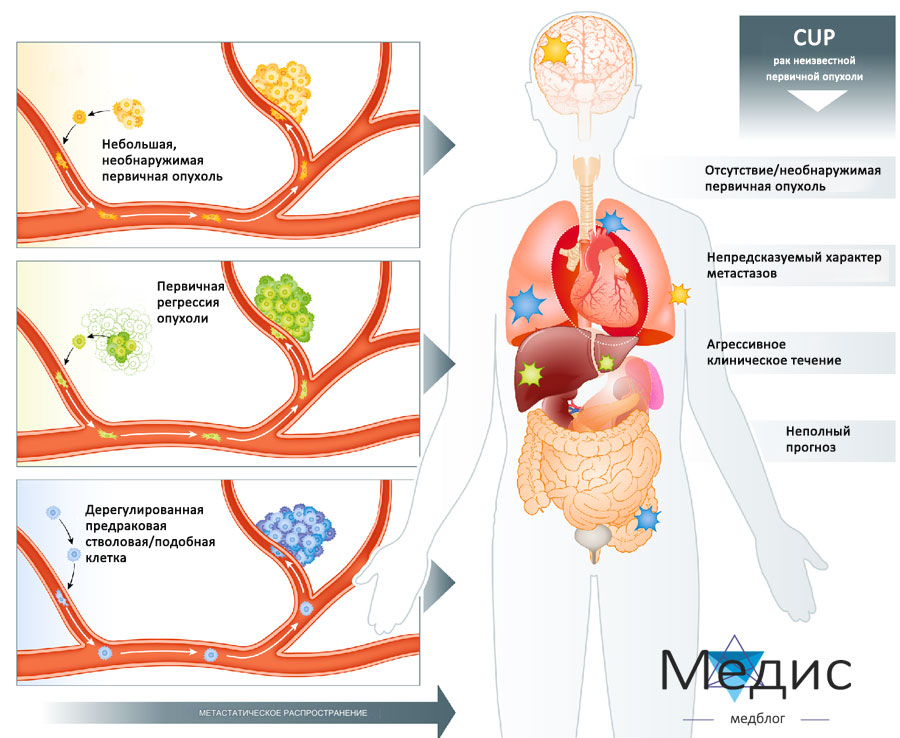
Врачи активно исследуют рак неизвестного происхождения (РНП), разрабатывая методы профилактики, улучшая лечение и обеспечивая наилучший уход для пациентов с этим диагнозом.
В рамках исследований рассматриваются различные аспекты: от клинических испытаний и новых возможностей для пациентов до использования генетики опухоли для диагностики первичного очага рака.
Генетика опухоли позволяет определить место возникновения рака. Различные ткани организма производят разные белки в зависимости от активности генов. Например, гены здоровых клеток лёгких отличаются от генов здоровых клеток толстой кишки. Когда рак возникает в другом месте организма, экспрессия генов обычно совпадает с местом его возникновения. Анализ образца опухоли, взятого при биопсии, может помочь определить, какие гены экспрессируются, и предсказать место начала рака.
Лечение, основанное на прогнозировании профиля экспрессии генов, используется вместо эмпирической химиотерапии для людей с CUP, которые не входят в определённую подгруппу. Клинические испытания продолжают изучать результаты лечения конкретного участка с использованием профилирования экспрессии генов.
Таргетная терапия направлена на конкретные гены и белки, участвующие в росте и выживании раковых клеток. Это позволяет более точно и эффективно бороться с заболеванием.
Узнайте больше об основах таргетной терапии на страницах сайта Клиники доктора Аронова.
Некоторые виды целевой терапии были одобрены Минздравом для лечения конкретных видов рака. Например, таргетная терапия HER2 при HER2-позитивном раке молочной железы, ингибиторы BRAF при меланоме с мутацией BRAF и ингибиторы EGFR при немелкоклеточном раке легкого с мутацией EGFR.
Однако в настоящее время не существует целевых препаратов, одобренных для лечения именно хронического универсального пролиферативного синдрома (CUP), а целевые препараты, одобренные для лечения других видов рака, не были протестированы для лечения CUP.
Поскольку CUP охватывает множество типов опухолей, вполне вероятно, что некоторые из них имеют молекулярные аномалии, на которые успешно воздействуют при других типах рака. До недавнего времени тестирование потенциальных молекулярных мишеней (таких как HER2, BRAF и EGFR) при CUP не проводилось.
Благодаря доступности комплексного молекулярного профилирования недавние исследования показали, что частота потенциально излечимых молекулярных аномалий (с использованием целевых методов лечения, уже одобренных для других видов рака) составляет около 25% в CUP.
Эффективность таргетной терапии, направленной на эти выявленные молекулярные аномалии, ещё не была должным образом проверена у пациентов с CUP. Однако у нескольких таких пациентов, прошедших лечение вне клинических испытаний, были получены отличные результаты. В текущих клинических испытаниях пациенты с CUP, чьи опухоли имеют определённые молекулярные аномалии, получают лечение препаратами, направленными против этих аномалий. Эти клинические испытания предоставляют широкие возможности для выявления дополнительных эффективных методов лечения CUP.
Иммунотерапия
Иммунотерапия — это метод лечения, который помогает иммунной системе бороться с раковыми клетками. За последние несколько лет было разработано множество новых препаратов для этого метода лечения.
Например, препараты, которые воздействуют на пути PD-1 и PD-L1, стали стандартным компонентом лечения нескольких распространённых видов рака, таких как рак лёгких, почек, мочевого пузыря, головы и шеи, а также некоторых видов рака груди и толстой кишки.
Поскольку у людей с CUP рак может начаться в любом из этих мест, исследователи считают, что некоторые люди с CUP также могут получить пользу от иммунотерапии. Помимо типа рака, было выявлено ещё несколько факторов, которые могут предсказать реакцию на иммунотерапию. К ним относятся высокая экспрессия PD-1 или PD-L1 в опухоли, высокая микросателлитная нестабильность (MSI-H) или высокая мутационная нагрузка опухоли (TMB). Все эти аномалии были обнаружены в CUP и могут быть выявлены с помощью комплексного молекулярного профилирования.
В настоящее время проводятся клинические испытания для изучения результатов лечения иммунотерапией людей с CUP. Более подробно о иммунотерапии читайте конце текста.
Новые виды лечения
Многие новые препараты впервые проходят испытания в ходе исследований, называемых клиническими испытаниями I фазы. Обычно эти клинические испытания проводятся не специально для CUP, а для пациентов с любыми видами рака, которые уже получили все стандартные виды лечения.
Цель этих исследований — определить побочные эффекты и оптимальные дозы новых препаратов, а также выяснить, могут ли они быть эффективными в борьбе с раком.
Паллиативная помощь / поддерживающая терапия. Проводятся клинические испытания, направленные на поиск лучших способов уменьшения симптомов и побочных эффектов современных методов лечения рака для повышения комфорта и качества жизни пациентов.
Что такое иммунотерапия?
Иммунотерапия — это один из методов лечения рака, в котором используются вещества, вырабатываемые организмом или создаваемые в лаборатории. Эти вещества помогают усилить иммунную систему и помогают организму находить и уничтожать раковые клетки.
Иммунотерапия может применяться для лечения различных видов рака как самостоятельно, так и в сочетании с другими методами лечения, такими как химиотерапия.
В этой статье мы расскажем вам об основах иммунотерапии и о том, как она работает для лечения рака. Также вы узнаете больше о возможных побочных эффектах этого метода лечения.
Как иммунная система борется с раком?
Иммунная система — это сложный механизм, который помогает организму бороться с раком. В этом процессе участвуют различные клетки, органы и белки. Однако рак может обойти многие естественные защитные механизмы иммунной системы, что позволяет раковым клеткам продолжать расти.
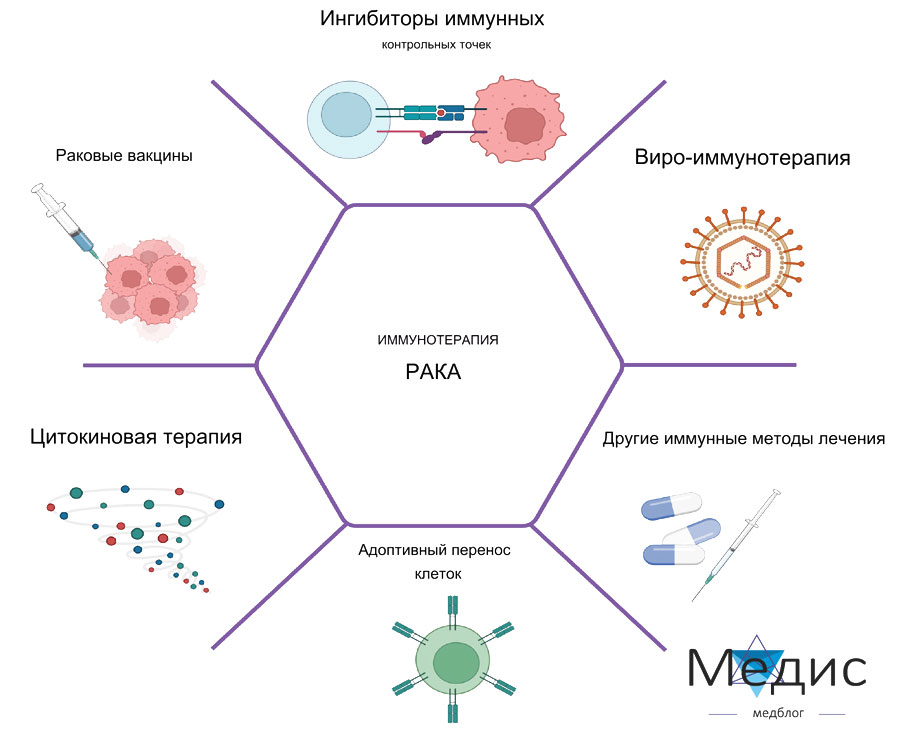
Существует несколько видов иммунотерапии, которые действуют по-разному. Некоторые из них помогают иммунной системе остановить или замедлить рост раковых клеток, другие — уничтожить раковые клетки или предотвратить распространение рака в другие части тела.
К различным видам иммунотерапии относятся:
- моноклональные антитела и ингибиторы иммунных контрольных точек;
- неспецифические иммунотерапевтические препараты;
- онколитическая вирусная терапия;
- Т-клеточная терапия;
- противораковые вакцины.
Тип иммунотерапии, доза и график лечения, которые рекомендует врач, зависят от многих факторов, таких как тип рака, размер, местоположение и степень распространения, а также ваш возраст, общее состояние здоровья, масса тела и возможные побочные эффекты. Важно обсудить с врачом, почему именно вам рекомендован тот или иной план иммунотерапии.
Что такое моноклональные антитела и ингибиторы контрольных точек иммунитета?
Когда иммунная система обнаруживает что-то вредное, она вырабатывает антитела — белки, которые борются с инфекцией, прикрепляясь к антигенам (молекулам, которые запускают иммунный ответ в организме). Моноклональные антитела производятся в лаборатории, чтобы усилить естественные антитела организма или выступить в роли антител.
Моноклональные антитела являются важным инструментом в борьбе с раком. Они могут блокировать активность аномальных белков в раковых клетках, что является одним из видов таргетной терапии — лечения рака с помощью лекарств, нацеленных на конкретные гены, белки или среду, которая способствует росту и выживанию опухоли.
Другие типы моноклональных антител усиливают иммунную систему, ингибируя или блокируя иммунные контрольные точки. Эти контрольные точки используются организмом для естественной остановки реакции иммунной системы и предотвращения её атаки на здоровые клетки. Однако раковые клетки могут активировать эти контрольные точки, чтобы скрыться от иммунной системы.
Ингибиторы контрольных точек не позволяют раковым клеткам блокировать работу иммунной системы. Они обычно воздействуют на такие точки, как PD-1/PD-L1 и CTLA-4.
Примерами ингибиторов контрольных точек являются:
- Pembrolizumab (Keytruda)
- Atezolizumab (Tecentriq)
- Dostarlizumab (Jemperli)
- Durvalumab (Imfinzi)
- Ipilimumab (Yervoy)
- Nivolumab (Opdivo)
- Avelumab (Bavencio)
Многие ингибиторы контрольных точек получили одобрение Минздрава для лечения конкретных видов рака. Также существуют два ингибитора контрольных точек, которые применяются для лечения опухолей в любой части организма, если они имеют определённые генетические изменения. Этот подход называется «лечение с диагностикой опухоли».
Например, пембролизумаб (Keytruda) одобрен для лечения опухолей, распространившихся на отдалённые части тела, если они имеют специфические молекулярные изменения, такие как микросателлитная нестабильность высокой степени (MSI-H) или дефицит репарации рассогласования ДНК (dMMR). Ещё один пример — достарлимаб (Jemperli), который может использоваться для лечения прогрессирующего рака или рака, который вернулся, при условии наличия dMMR.
Побочные эффекты при лечении моноклональными антителами зависят от назначения препарата. Например, побочные эффекты моноклональных антител, используемых для таргетной терапии, отличаются от тех, которые применяются для иммунотерапии. Побочные эффекты ингибиторов контрольных точек иммунитета могут включать симптомы, похожие на аллергическую реакцию.
Если вы уже устали читать столь специальные материалы, просто приходите на консультацию к доктору Аронову в Медис, чтобы вести предметный разговор.